qPCR服务
实时荧光定量PCR(real-time quantitative PCR)/qRT-PCR,是指在PCR反应体系中加入荧光标记物,利用荧光信号积累实时监测整个PCR进程,最后通过扩增曲线对未知模板进行定量分析的方法。一般用于mRNA转录水平的定量研究、不同样本或基因组中DNA拷贝数的测定、基因芯片结果验证、药效分析等。

| 1 | 2 | 3 | 4 | 5 | 6 |
| 材料接收 | RNA抽提 | cDNA合成 | 定量实验 | 数据分析 | 结果交付 |
|
项目类型 |
检测方法 |
荧光定量PCR服务价格 |
||
|
荧光定量 |
SYBR Green染料法 |
位点调试费 |
RNA提取+逆转录 |
定量pcr三复孔 |
|
200元/基因 |
100元/样品 |
100元/基因/样品 |
||
◆ 备注
1、绝对定量,标准曲线另外收取(260元/基因)。
2、探针法,探针需另外收取费用(500元/条,默认FAM、BHQ)。
1. 绝对定量:用已知浓度的标准品绘制标准曲线,而后通过标准曲线对未知浓度的检测样品进行绝对量(起始拷贝数)分析。
2. 相对定量:以内参基因为参照,比较两个或两个以上样本中某个基因表达量的变化,通常用来对mRNA表达量进行分析。一般采用2-ΔΔ Ct 法进行计算。每个样本重复三次。
1. mRNA表达量水平检测:相对定量法。
2. MicroRNA表达量水平检测:通过设计特殊茎环结构的反转录引物,结合实时定量PCR可以精确检测微量样品中microRNA表达水平。内参基因一般用U6。
3. 基因拷贝数检测:如检测样品中不同细菌含量、基因工程菌目的基因拷贝数、环境中耐药基因检测等。采用绝对定量法。
扩增曲线
在RT-qPCR中,对整个PCR反应扩增过程进行了实时的检测并记录其荧光信号,随着反应的进行,监测到的荧光信号可以绘制成一条曲 线,即为扩增曲线。荧光扩增曲线一般分为基线期、指数增长期和平台期。
在RT-qPCR扩增早期,扩增的荧光信号被荧光背景信号所掩盖,无法判断产物量的变化,此时即为基线期。
PCR反应过程中产生的DNA拷贝数是呈指数形式增加的,随着反应循环数的增加,最终PCR反应不再以指数形式生成模板,从而进入 “平台期”。在该时期,扩增产物已不再呈指数级的增加,PCR的终产物量与起始模板量之间无线性关系,所以根据最终的PCR产物量 不能计算出初始模板量。
只有在荧光信号的指数增长期,PCR产物量的对数值与起始模板量之间存在线性关系,可以选择在这个阶段进行定量分析。

荧光阈值
为了便于对所检测样本进行比较,首先需设定一个荧光信号的阈值,荧光阈值是在扩增曲线上人为设定的一个值,它可以设定在指数扩增阶段任意位置上,一般荧光阈值设置为3~15个循环的荧光信号的标准偏差的10倍,但实际应用时要结合扩增效率、线性回归系数等参数来综合考虑。通常荧光阈值都是RT-qPCR仪器自动设置,如无特殊情况,无需更改。
循环阈值
循环阈值(Cycle threshold valve,Ct)即RT-qPCR扩增过程中扩增产物的荧光信号达到设定的荧光阈值时所经过的扩增循环次数Ct值与荧光阈值有关。
—般Ct值位于指数增长期的开始阶段,此时样品间细小误差尚未放大且扩增效率也相对恒定,因此该Ct值具有极好的重复性,尽管平台期的DNA拷贝数波动很大,Ct值却是相对固定的。
计算公式
对于一个理想的RT-qPCR反应:Xn=X0×2n;对于一个非理想的RT-qPCR反应:Xn=X0×(l+E%)n,其中,n为扩增反应的循环次数,Xn为第n次循环后的产物量,X0为初始模板量,E%为扩增效率;在RT-qPCR中,在扩增产物达到荧光阈值线时:Xct=X0×(l+E%)ct,其中,X0为荧光扩增信号达到阈值强度时扩增产物的量,在荧光阈值设定以后,Xct为一个常数;将上述公式两边取对数,并换算可得如下公式:lgX0=-lg(l+E%)ct+lgXct;即Ct值与lgX0呈负相关,据此即可计算出样本中所含的初始模板量。
- 1、须提供新鲜的足量材料(细胞数106个以上,组织100 mg以上),样品-70℃快递至本公司(干冰或液氮运送,以保证样品质量),亦可提供保证质量的DNA或RNA样品(2 μg以上);
- 2、提供靶基因信息,包括基因序列或GenBank Accession Number等。
- 3、提供详细的背景资料,生物物种信息(Human、Mouse、Rat等)、DNA/RNA来源、基因丰度等。
1、从不同样品中提取核酸(DNA或RNA);
2、对核酸进行浓度及纯度评级;
3、荧光定量PCR检测;
① 引物或探针的设计与合成;
② 相对定量或绝对定量的选择;
③ 探针法或染料法的选择;
④ 荧光定量PCR仪对目的基因的检测;
⑤ 数据统计和分析(RNA浓度及质量检测报告、荧光定量PCR原始数据及优化数据、扩增曲线、溶解曲线、表达柱形图等);
4、预实验服务:根据客户提供的目的基因序列或NCBI序列号提供客户引物或探针,并筛选出最优化的引物或探针;
5、正式实验服务:根据预实验筛选的引物或探针对所用样品进行荧光定量PCR的检测,并对结果进行统计和分析。
2、结果导出文件,Excel表格(包含Ct值);
3、相对表达量计算文件,Excel表格(包含相对表达量、计算过程);
4、电子版实验报告,Word文档(包含实验过程,相对表达量统计、情况说明等)。
1、组织速冻时间:组织离体后,胞内核酸便开始降解,尤其是RNA,故采集时,目的组织离体后,需立即速冻,建议5min内完成,越快 越好。
2、组织送样量:送样量过少或过多均不利于提取实验,下限为建议量的一半,上限为建议量的3倍。
3、组织保存管的选择:所有组织样品务必使用离心管或螺纹管保存,切勿直接装入密封袋保存(低温冻脆易破裂,导致样品泄露,交叉污 染)。
4、组织样品保存方法选择:首选液氮速冻;没有液氮条件的,可直接放入-80℃冰箱冻存。
5、冻融组织:组织冻存后,一旦冻融,RNA降解概率大于80%,几乎不可能提取成功,此类组织不建议送样。送样前确保组织未发生过 冻融情况。
6、对于同一个组织样品需要同时提取DNA和RNA的,请务必分成两管分批次送样。
| 实验问题 | 原因 | 推荐解决方法 |
| Ct 值起跳过晚 | 引物设计不佳 | 重新设计引物,RT—PCR摸索好扩增条件。 |
| 扩增效率低 | 降低退火温度,适当提高镁离子浓度;PCR产物长度控制在100bp左右;荧光染料未降解。 | |
| 模版量低 | 增加反应循环数,提高模版量。 | |
| 无Ct 值起跳 | 引物设计不佳 | 重新设计引物,RT—PCR摸索好扩增条件。 |
| 模板量低 | 增加反应循环数,提高模板量。 | |
| 熔解曲线出现双峰? | 非特异性扩增条带 | 优化PCR反应条件,如提高退火温度,降低镁离子浓度;若优化失败需重新设计引物。 |
| 引物二聚体 | 降低引物浓度或重新设计引物。 | |
| 基因组污染 | 抽提获得的RNA用DNase I消化基因组DNA后进行后续实验。 |
-

基因合成
基因合成是生物学中一项最基本的、最常用的技术。对DNA调控元件、基因、途径乃至整个基因组的合成是验证生物学假设和利用生物学为人类服务的有力工具,与寡核苷酸合成有所不同:寡核苷酸是单链的,所能合成的最长片段仅为100nt左右,而基因合成则为双链DNA分子合成,所能合成的长度范围50 bp-12 kb。 基因合成是用人工方法合成基因的技术,是基因获取的手段之一,相对于从已有生物中获取基因来说,基因合成无需模板,因而不受基因来源限制。
-

ORF克隆
ORF克隆是指从样本组织或细胞中抽提总RNA,反转录,设计合成特异性引物后,通过RT-PCR扩增获得目的基因的DNA序列,获得编码全长蛋白质序列的DNA序列:即从起始密码ATG到终止密码子,不含5′和3′UTRs非翻译区及内含子序列。
-
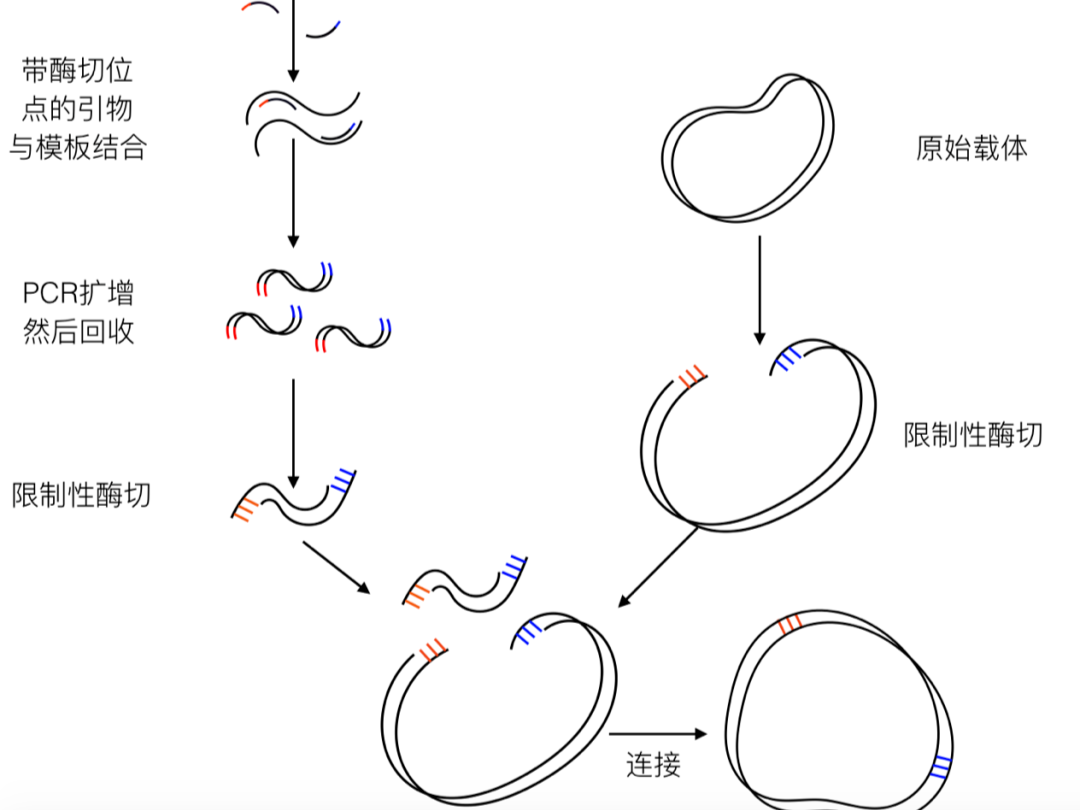
载体构建
构建表达载体是基因工程的核心,但由于影响因素较多,使得高质量的载体很难获得。其云生物依托质粒库及基因合成技术、基因编辑等技术,可为您高效快速构建载体。
-

STTM载体服务
STTM是人工合成的一段短串联靶标模拟物,中间有一段48nt左右的特定核昔酸序列,两端分别有目标miRNA结合位点,每段miRNA结合序列包括3个非互补碱基(CTA),该序列能与目标miRNA结合形成非完全互补双链,从而有效地阻止miRNA与目的基因结合,使miRNA沉默,使目的基因表达量升高(Yan etaL, 2012)。 STTM技术是研究体内miRNA的有效工具,使miRNA的沉默,使miRNA的靶基因表达量升高,该技术已被广泛应用在拟南芥、水稻、番茄、大豆等miRNA的功能研究(Zhang et al., 2017)
-
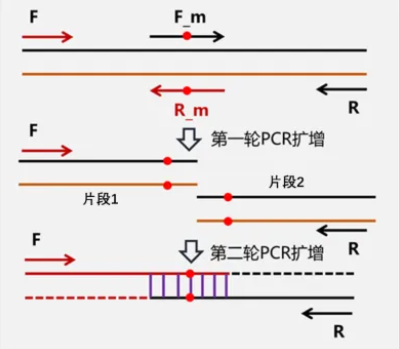
定点突变
定点突变是指通过PCR等方法向目的DNA片段中引入所需变化,包括碱基的添加、删除、点突变等。定点突变能迅速、高效地提高DNA所表达的目的蛋白的性状及表征,是基因研究工作中一种非常有用的手段。









